Infertilità maschile

Cosa è l’infertilità maschile
L'infertilità è definita come l'incapacità di una coppia sessualmente attiva, che non adopera metodi contraccettivi, di ottenere una gravidanza spontanea in un anno. (OMS, 1995).
Circa il 15% delle coppie non ottengono una gravidanza entro 1 anno e cercano un trattamento medico per l'infertilità. Alla fine, meno del 5% rimane senza ottenere un figlio.
Cause di infertilità maschile
I principali fattori che influenzano la prognosi di infertilità sono:
• la durata della sterilità
• infertilità primaria o secondaria
• risultati dello spermiogramma
• età e lo stato di fertilità del partner femminile
L'urologo dovrebbe esaminare qualsiasi maschio con problemi di fertilità per valutarne le anomalie urogenitali.
Segni e sintomi della infertilità maschile
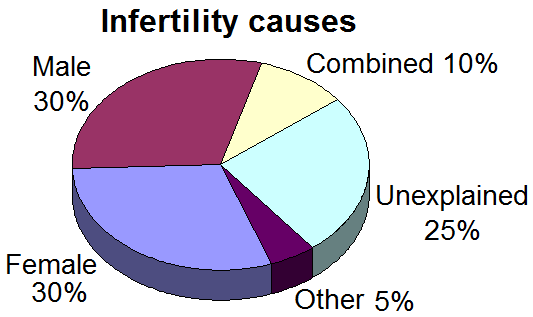
La diagnosi della infertilità maschile dovrebbe concentrarsi su un numero di Patologie prevalenti di base. Sarebbe consigliata una valutazione simultanea del partner femminile, anche se le anomalie si trovano nel maschio, perchè i dati mostrano che in 1 coppia su 4 troviamo concomitanti disfunzioni sia maschili che cause di infertilità femminile.
Spermiogramma
Lo spermiocitogramma costituisce la base su cui prendere decisioni riguardanti ulteriori trattamenti. L'analisi deve essere effettuata in un laboratorio che aderisce agli standard nazionali di controllo della qualità.
Limiti di riferimento dello spermiogramma
Volume di sperma ( ml): 1,5 ( 1,4-1,7 )
Numero di spermatozoi totale ( 106 per eiaculato ): 39 ( 33-46 )
Concentrazione degli spermatozoi ( 106 per mL ): 15 ( 12-16 )
Motilità totale ( PR + NP , % ): 40 ( 38-42 )
Motilità progressiva ( PR , % ): 32 ( 31-34 )
Vitality ( spermatozoi vivi , % ): 58 ( 55-63 )
La morfologia degli spermatozoi ( forme normali , % ): 4 ( 3,0-4,0 )
Altri valori soglia
pH ≥ 7.2, Leucociti perossidasi – positivi ( 106 per ml ) < 1.0 MAR test ( spermatozoi mobili con particelle legate , % ) < 50
Test Immunobead ( spermatozoi mobili con aggregati associati, % ) < 50
Zinco seminale ( micromol / eiaculato ) ≥ 2.4
Fruttosio seminale ( micromol / eiaculato ) ≥ 13
Glucosidasi neutra seminale ( mU / eiaculato ) ≥ 20
“ CHI manuale per analisi dello sperma , 5th edn , 2010”.
Interpretazione dello spermiogramma
Se i valori sono normali, un test dovrebbe essere sufficiente. Se i risultati sono anormali, lo spermiogramma deve essere ripetuto. È importante distinguere tra oligozoospermia ( < 15 milioni spermatozoi / ml ), astenozoospermia ( <40 % spermatozoi mobili ) e teratozoospermia ( < 4 % forme normali ). Molto spesso, tutti e tre i fenomeni si verificano allo stesso tempo dando una sindrome da oligo - astheno - teratozoospermia ( OAT ). In casi estremi di sindrome OAT ( < 1 milione di spermatozoi / ml ), come nella azoospermia, vi è una maggiore incidenza di anomalie genetiche e / o ostruzione del tratto genitale maschile.
Esami ormonali nella infertilità maschile
Disfunzioni endocrine sono più frequenti negli uomini infertili rispetto alla popolazione generale, ma sono ancora abbastanza rare .
Lo screening ormonale
può essere limitata alla determinazione dei livelli di ormone follicolo-stimolante ( FSH ), ormone luteinizzante ( LH ), testosterone e androgeni (SHBG ) in caso di parametri seminali anormali. Negli uomini con diagnosi con azoospermia o estrema OAT, è importante distinguere tra cause ostruttive e cause non ostruttive. E’ ragionevole pensare a cause di infertilità non ostruttive quando ritroviano normali valori di FSH con un volume testicolare normale bilateralmente. Tuttavia, il 29 % degli uomini infertili con un normale FSH sembrano hanno spermatogenesi difettoso.
Ipogonadismo ipergonadotropo (elevata FSH / LH )
La spermatogenesi alterata associata ad elevati livelli di gonadotropine è un problema comune ed è dovuta insufficienza testicolare primitiva. Le cause includono:
• Cause di ipogonadismo Congenite
- Sindrome di Klinefelter, anorchia, criptorchidismo, disgenesia testicolare, microdelezioni cromosoma Y
• Cause di ipogonadismo acquisite
- dopo orchite, torsione testicolare, tumore testicolare, malattia sistemica, terapia citotossica.
Ipogonadismo ipogonadotropo ( basso FSH / LH )
Bassi livelli di gonadotropine a causa di una disfunzione della ghiandola pituitaria ghiandola o dell'ipotalamo sono rare e possono verificarsi come risultato di :
• Anomalie congenite
- ipogonadotropo idiopatico
Ipogonadismo ( IHH ), la sindrome di Kallmann, Sindrome di Prader- Willi
• anomalie acquisite
- malattie delle ghiandole ipotalamo acquisite / ipofisi ( tumori maligni del sistema nervoso centrale, ipofisi
adenoma, iperprolattinemia, malattia granulomatosa, emocromatosi )
• I fattori esogeni
- farmaci (steroidi anabolizzanti, obesità, irradiazione ).
Se è presente un inspiegabile ipogonadismo ipogonadotropo, la visita medica dovrebbe comprendere la risonanza magnetica (MRI) della ghiandola pituitaria.
valutazione microbiologica nella infertilità maschile
Indicazioni per la valutazione microbiologica includono, infezioni del tratto urinario, infezioni delle ghiandole accessorie maschili ( MAGI ) e le malattie sessualmente trasmissibili (MST ). I globuli bianchi rilevati in un campione di sperma, in combinazione con un piccolo volume eiaculato, può indicare una (parziale ) ostruzione dei dotti eiaculatori causate da un'infezione ( cronica ) di prostata o vescicole seminali. Infezioni dei genitali possono avviare la produzione di radicali liberi dell’ossigeno con spemotossicità. Infezione da Neisseria gonorrea e Chlamydia trachomatis possono anche causare ostruzione del tratto genitale. Anche se le procedure antibiotica per MAGI potrebbero fornire miglioramento della qualità dello sperma , la terapia non necessariamente aumentare la probabilità di concepimento.
Valutazione genetica per l’infertilità maschile
Un numero consistente di disturbi della fertilità maschile descritti come infertilità idiopatica ha un origine genetica. Ricerca di delezioni del cromosoma Y non solo fornisce una diagnosi, ma anche consente consulenza genetica appropriata. Quest'ultima può essere molto importante con l'avvento di iniezione intracitoplasmatica di spermatozoi ( ICSI ), perché i difetti genetici possono essere trasferiti ed una traslocazione equilibrata del padre infertile può diventare sbilanciata nella prole.
Anomalie cromosomiche
sono più comuni negli uomini con OAT e con azoospermia, e la valutazione del cariotipo in questi uomini ha scopo sia diagnostico e per la consulenza genetica. La sindrome di Klinefelter ( 47, XXY ), è l’anomalia cromosomica più comune nel maschio che colpisce circa il 14 % di uomini con diagnosi di azoospermia. La sindrome di Klinefelter è caratterizzata da ipogonadismo ipergonadotropico che può essere associato con le caratteristiche eunucoidi e / o ginecomastia . Entrambi i testicoli sono molto piccoli a causa di una vasta sclerosi tubolare. Nel 60 % di tutti i pazienti , i livelli di testosterone diminuiscono con l'età che richiedono la terapia sostitutiva con androgeni. Inoltre, traslocazioni cromosomiche e le delezioni possono essere osservate, e se ereditarie causano aborto abituale e malformazioni congenite nella prole. In casi di azoospermia o grave OAT, ci possono essere delezioni nel fattore azoospermici ( AZF ) regione del cromosoma Y e si consiglia il test. La prevalenza di delezioni Y è considerevole ( circa il 5 % ) in questo gruppo di pazienti. Quando si esegue la ICSI con spermatozoi chirurgicamente recuperati o spermatozoi da eiaculato, sulla base di una diagnosi di assenza dei vasi deferenti ( CAVD ) congenita bilaterale / unilaterale, sia il maschio e la partner femminile dovrebbero essere testati per mutazioni del gene della fibrosi cistica, regolatore transmembrana ( CFTR ). Oltre a causare fibrosi cistica ( CF ), questo gene è anche associato con CAVD ed in oltre l'85 % di tutti i maschi con diagnosi di CAVD si trova positività anche per due mutazioni del gene CFTR quando l'intero gene viene sequenziato. La consulenza genetica è obbligatoria in questi casi.
L’ecografia nella diagnosi di infertilità maschile
L'ecografia ( US) è uno strumento utile per individuare danni intrascrotali.
L’eco-color-doppler scrotale può rilevare un varicocele in circa il 30 % dei maschi subfertili. I tumori testicolari possono essere trovati in 0,5 %, e microcalcificazioni testicolari (a condizione potenzialmente precancerose ) vengono rilevati in circa 2-5 % dei maschi subfertili, soprattutto i pazienti con diagnosi di unstoria di criptorchidismo. L’ecografia transrettale ( TRUS ) è indicata in uomini con un basso volume del liquido seminale ( < 1,5 ml ) escludere ostruzione dei dotti eiaculatori causati da una cisti lungo la linea mediana prostatica o stenosi dei dotti eiaculatori.
Ruolo della biopsia testicolare nella infertilità maschile
La biopsia testicolare è di solito eseguita come parte di un percorso terapeutico in pazienti azoospermici ( recupero di spermatozoi testicolari- TESE ) che decidono di sottoporsi ICSI. Indicazioni per l'esecuzione una biopsia testicolare diagnostico potrebbe essere: azoospermia o estrema OAT, in presenza di un volume testicolare normale e livelli normali di FSH. La biopsia è rivolta a differenziare tra insufficienza testicolare e ostruzione del tratto genitale maschile. Si consiglia, durante la procedura, tessuto che contiene spermatozoi da crioconservare per futuri tentativi di ICSI. Inoltre le , biopsie testicolari vengono eseguite per rilevare carcinoma in situ del testicolo negli uomini infertili con testicolare microcalcificazioni e fattori di rischio per il cancro testicolare (cioè infertilità maschile , criptorchidismo, storia di un tumore testicolare, atrofia testicolare ).
Classificazioni patologiche applicate nelle biopsie testicolari :
• Assenza di tubuli seminiferi ( sclerosi tubulare )
• assenza di cellule germinali ( only cell Sertoli sindrome )
• Maturazione arresto - spermatogenesi arrestato a diverso stadi ( spermatogoni, spermatociti o spermatidi )
• ipospermatogenesi - tutti i tipi di cellule fino a spermatozoi sono presenti, ma vi è un netto calo del numero di spermatogoni.
Rimedi e cura della infertilità maschile
Counselling
Lo stile di vita può compromettere la qualità dello sperma, ad esempio fumo eccessivo, abuso di alcol, uso di steroidi anabolizzanti, sport estremi ( maratona formazione, sport di forza eccessiva ) e un aumento temperatura scrotale attraverso la biancheria intima termica, sauna o nella vasca uso idromassaggio, o l'esposizione professionale a fonti di calore. Un considerevole numero di farmaci possono influenzare la spermatogenesi.
Terapia medica della infertilità maschile
Trattamento antiossidante ( acido folico, vitamina E, zinco, selenio ) possono avere un'influenza positiva sulla qualità dello sperma, ma le coppie infertili devono essere informate che prova corrente sul loro beneficio per promuovere la gravidanza è inconcludente. Nessuno studio ha confermato che le terapie ormonali, come gonadotropine umane della menopausa ( HMG ) / gonadotropina corionica umana ( HCG ) , androgeni , anti- estrogeni ( clomifene e tamoxifene ), gli inibitori della prolattina ( bromocriptina ) e steroidi, hanno migliorato i tassi di gravidanza negli uomini con OAT idiopatica. Tuttavia, alcune patologie principalmente endocrinologici possono essere trattate con terapia medica, tra cui :
• Ridotti valori sierici di testosterone : clomifene citrato 50 mg / die o tamoxifene 20 mg / die
• ipogonadismo ipogonadotropo : avviare HCG 1500 UI 3 volte alla settimana, e aggiungere HMG o FSH 75-150 UI 3 volte a settimana, fino a quando si verifica la spermatogenesi
• iperprolattinemia : agonisti della dopamina.
Nei pazienti con anticorpi anti- sperma , alte dosi di steroidi non sono raccomandati a causa di gravi effetti collaterali e dei discutibili benefici.
Il trattamento chirurgico e rimedi non conservativi dell’infertilità maschile
varicocele
Il trattamento del varicocele è un argomento controverso, soprattutto basato sul fatto che vi è una reale necessità per il trattamento di varicocele negli uomini infertili. Ci sono prove di parametri seminali migliorati dopo il trattamento varicocele successo. Le informazioni correnti supporta l'ipotesi che in alcuni uomini, la presenza di varicocele è associato con danno testicolare progressivo dall'adolescenza in poi e conseguente riduzione della fertilità. Sebbene il trattamento del varicocele negli adolescenti può essere efficace, vi è un rischio significativo di sovra-trattamento. In casi di normale analisi dello sperma e negli uomini con varicocele subclinico, sembra che non vi sia alcun beneficio dal trattamento rispetto osservazione. Trattamento del varicocele, tuttavia, sembra efficace nelle coppie in cui gli uomini ha un oligo o astenozoospermia, un varicocele clinico, e altrimenti inspiegabile forma di infertilità.
Microchirurgia / vaso-vasostomia ed epididimo-vasostomia
Solo urologi con esperienza in microchirurgia dovrebbero intraprendere queste procedure utilizzando un microscopio operatorio. La probabilità di iniziare la gravidanza è inversamente proporzionale all'intervallo di ostruzione e diventa meno del 50 % dopo otto anni. Altri importanti fattori prognostici sono la qualitàdello sperma dopo la procedura e l'età del partner. In circa il 15 % degli uomini che hanno subito una vasovasostomia, la qualità dello sperma si deteriora al livello di azoospermia o di estrema oligospermia entro 1 anno. A volte un ostacolo dell'epididimo coesiste, soprattutto negli uomini con un lungo intervallo tra vasectomia e vasovasostomia. In questi uomini è indicato una vaso- epididimostomia. Considerando che un vaso- epididimostomia ha un effetto limitato su tassi di gravidanza ( 20-30 %), è consigliabile combinare questa procedura con microchirurgica di aspirazione epididimali sperma ( MESA ), e crioconservare gli spermatozoi raccolti per ICSI. Le indicazioni per vaso-epididimostomia comprendono ostruzioni a livello dell'epididimo in presenza di una normale spermatogenesi ( biopsia testicolare ). MESA / TESE MESA / testicolare estrazione di spermatozoi ( TESE ) in combinazione con ICSI è indicata negli uomini con azoospermia ostruttiva quando la ricostruzione ( vasovasostomia, vaso-epididymostomy ) non può essere eseguita o non è riuscita. Un'alternativa sarebbe essere l'aspirazione percutanea di spermatozoi dalla testa dell’epididimo ( PESA ). Nel 50-60 % degli uomini con azoospermia ( NOA ) non-ostruttiva, possono essere trovati spermatozoi nel testicolo. Alcuni autori raccomandano di prendere diversi campioni testicolari, mentre altri sostengono la raccolta microchirurgica degli spermatozoi. In caso di AZFa e AZFb microdelezioni, senza spermatozoi possono essere recuperati . Incisione transuretrale dei dotti eiaculatori o di cisti prostatica sulla linea mediana. Ostruzioni distali del tratto genitale sono comunemente causate da infezioni dell'uretra prostatica e di ghiandole l'accessorie. Il trattamento dell'ostruzione mediante incisione transuretrale della cisti o dei dotti eiaculatori ostruiti, può portare ad un aumento nella quantità dello sperma, ed occasionalmente, gravidanza spontanea. I risultati a lungo termine, tuttavia , sono deludenti.
Disturbi della eiaculazione
Eiaculazione retrograda e aneiaculazione possono verificarsi:
• Nelle malattie neurologiche, ad esempio sclerosi multipla, diabete mellito ( neuropatia ) e lesioni del midollo spinale
• A seguito di intervento chirurgico alla prostata, chirurgia del collo vescicale, simpaticectomia e chirurgia retroperitoneale, ad esempio dissezioni linfonodale per i tumori testicolari
• Durante la terapia antidepressiva. La diagnosi si basa sulla storia medica e del dosaggio degli spermatozooi nelle urine del post- eiaculato. Eiaculazione retrograda dovrebbe essere sospettata se il volume di eiaculato è molto basso (parziale eiaculazione retrograda ).
Trattamento di eiaculazione retrograda
Tendono a rimuovere la causa del disturbo o a raccogliere gli spermatozoi dal urine dopo l'orgasmo. L’aneiaculazione può essere trattata con vibrostimulatore o tecniche di elettro- eiaculazione. È possibileindurre l'eiaculazione in circa il 90 % dei pazienti con lesioni del midollo spinale. Tuttavia, la qualità dello sperma è spesso scadente con un basso numero di spermatozoi mobili e di un aumento dei tassi di frammentazione DNA. Questo spiega i risultati deludenti di tecniche di riproduzione assistita in questi casi.